新聞中心
不(bù)管是(shì)在(zài)藥物研發還是(shì)基礎科研中,檢測蛋白與小分子(zǐ)的(de)相互作用都是(shì)一(yī / yì /yí)類重要(yào / yāo)的(de)實驗。小分子(zǐ)最主要(yào / yāo)的(de)特點是(shì)分子(zǐ)量較小,一(yī / yì /yí)般在(zài)1000 Da以(yǐ)下;并且結構性質各異,部分溶解度較差,需要(yào / yāo)使用有機溶劑(例如DMSO等)促溶;這(zhè)些特點給相互作用的(de)檢測帶來(lái)很大(dà)的(de)挑戰。基于(yú)SPR(表面等離子(zǐ)體共振)原理的(de)Biacore系統具有靈敏度高、可進行溶劑校正等優勢,不(bù)僅可以(yǐ)檢測較低的(de)信号,且對分子(zǐ)量差異懸殊的(de)互作類型也(yě)能精确檢測,同時(shí)還能消除有機溶劑帶來(lái)的(de)影響,因此越來(lái)越多的(de)研究者選擇Biacore進行蛋白與小分子(zǐ)相互作用檢測。
我們将根據智荟專線收集到(dào)的(de)客戶反饋,針對Biacore系統檢測蛋白與小分子(zǐ)相互作用實驗中常出(chū)現的(de)代表性問題,分上(shàng)下兩篇進行簡單的(de)分享與讨論。本篇爲(wéi / wèi)上(shàng)篇,将主要(yào / yāo)圍繞實驗設計和(hé / huò)樣品準備方面的(de)問題展開介紹。
一(yī / yì /yí)、配體的(de)固定策略以(yǐ)及芯片的(de)選擇
對于(yú)配體(固定相)采用合理的(de)固定方式并達到(dào)所需的(de)固定量,是(shì)Biacore實驗邁向成功的(de)第一(yī / yì /yí)步。然而(ér)所有基于(yú)傳感器表面的(de)檢測技術,都會面臨“物質遷移效應”的(de)影響,所以(yǐ)根據實驗類型及科學的(de)偶聯量計算公式去控制偶聯量非常關鍵。爲(wéi / wèi)此,目前僅有Biacore具備這(zhè)樣嚴謹的(de)計算公式,這(zhè)其中固定量的(de)計算方式主要(yào / yāo)就(jiù)是(shì)參考以(yǐ)下核心方程式,并且其不(bù)僅适用于(yú)直接偶聯法的(de)偶聯量計算,也(yě)可用于(yú)捕獲法的(de)捕獲量計算:

公式中,RL爲(wéi / wèi)配體的(de)固定量,Rmax爲(wéi / wèi)芯片表面的(de)最大(dà)結合容量,Sm爲(wéi / wèi)化學計量比(未知情況時(shí)可先設爲(wéi / wèi)1)。此公式可以(yǐ)簡單理解爲(wéi / wèi),Biacore中産生的(de)響應值信号反映的(de)是(shì)芯片表面質量的(de)變化。一(yī / yì /yí)般情況下,對于(yú)動力學分析,要(yào / yāo)求Rmax ≤ 50 RU;對于(yú)親和(hé / huò)力分析,要(yào / yāo)求Rmax ≤ 100 RU。由此計算得到(dào)理論固定量RL,在(zài)偶聯法中實際固定量可能需要(yào / yāo)1.5~3RL;在(zài)捕獲法中,則可以(yǐ)按照理論固定量來(lái)設定配體的(de)捕獲量,因爲(wéi / wèi)捕獲過程的(de)分子(zǐ)朝向固定,條件一(yī / yì /yí)般也(yě)是(shì)溫和(hé / huò)的(de)接近中性,最大(dà)程度地(dì / de)保留的(de)配體分子(zǐ)的(de)活性。
對于(yú)上(shàng)面的(de)核心方程式有了(le/liǎo)基本的(de)了(le/liǎo)解之(zhī)後,就(jiù)可以(yǐ)回答下面這(zhè)些問題了(le/liǎo)。
1是(shì)選擇固定蛋白還是(shì)固定小分子(zǐ)?
首先需要(yào / yāo)明确的(de)是(shì),如果您的(de)實驗目的(de)是(shì)想獲得精确的(de)親和(hé / huò)力數值,那建議選擇固定蛋白。考慮到(dào)小分子(zǐ)的(de)固定難度、空間位阻以(yǐ)及固定過程對于(yú)結合的(de)影響等方面的(de)問題,選擇氨基偶聯的(de)方式固定蛋白往往是(shì)最簡單、有效的(de)固定方式。而(ér)小分子(zǐ)本身的(de)活性基團有限,基團的(de)反應活性也(yě)與蛋白存在(zài)一(yī / yì /yí)定的(de)差異,偶聯條件需要(yào / yāo)摸索,另外,通過這(zhè)些基團的(de)偶聯反應可能也(yě)破壞了(le/liǎo)小分子(zǐ)僅有的(de)結合反應活性位點。因此,隻有對于(yú)某些特定類型的(de)定性實驗,比如分子(zǐ)垂釣,固定小分子(zǐ)也(yě)是(shì)可行的(de),通常推薦的(de)固定方式是(shì)使用SA芯片固定生物素修飾後的(de)小分子(zǐ),可以(yǐ)在(zài)比較明确的(de)條件下實現穩定的(de)固定,而(ér)且生物素分子(zǐ)在(zài)一(yī / yì /yí)定程度上(shàng)可以(yǐ)起到(dào)間隔臂(spacer arm)的(de)作用,減少小分子(zǐ)結合受到(dào)的(de)空間位阻影響。
綜上(shàng)所述,固定蛋白的(de)過程相對簡單也(yě)适用于(yú)大(dà)多數結合反應,因此是(shì)目前探究蛋白與小分子(zǐ)互作時(shí)最常用的(de)選擇。
2固定蛋白是(shì)選擇直接偶聯還是(shì)捕獲法?
先說(shuō)結論:我們建議,進行蛋白與小分子(zǐ)互作實驗時(shí)優先考慮直接偶聯蛋白的(de)方式。
直接偶聯(氨基偶聯)法的(de)操作方法較簡便、明确,而(ér)且可以(yǐ)實現較高的(de)偶聯量,在(zài)小分子(zǐ)作爲(wéi / wèi)分析物時(shí),有利于(yú)獲得比較理想的(de)響應值。例如常用的(de)CM5芯片,最高偶聯量可以(yǐ)到(dào)10000 – 15000 RU,非常适合蛋白與小分子(zǐ)此類分子(zǐ)量差異懸殊的(de)檢測。除了(le/liǎo)直接偶聯法以(yǐ)外,根據樣品性質與分子(zǐ)量差異,捕獲法也(yě)是(shì)一(yī / yì /yí)種您可以(yǐ)選擇的(de)固定策略,例如:待固定的(de)樣品未經純化,含有其他(tā)雜質;或者擔心直接偶聯的(de)過程會影響結合位點等。在(zài)這(zhè)些情況下,可以(yǐ)考慮通過捕獲法固定配體。當配體樣品的(de)純度不(bù)夠時(shí),捕獲的(de)過程相當于(yú)在(zài)芯片表面進行了(le/liǎo)一(yī / yì /yí)次在(zài)線純化;捕獲過程的(de)條件較爲(wéi / wèi)溫和(hé / huò),可以(yǐ)盡可能地(dì / de)保留配體的(de)結合活性,同時(shí)保證配體自由朝向,充分暴露結合位點。
常用的(de)捕獲類芯片以(yǐ)NTA芯片爲(wéi / wèi)例,這(zhè)是(shì)一(yī / yì /yí)種可以(yǐ)通過螯合鎳離子(zǐ)捕獲帶有His标簽蛋白的(de)捕獲芯片。如下圖1所示,NTA芯片上(shàng)捕獲量大(dà)約在(zài)3000 – 4000 RU[1]最爲(wéi / wèi)穩定,非常适合His标簽蛋白與小分子(zǐ)二者分子(zǐ)量差異不(bù)是(shì)特别大(dà)的(de)親和(hé / huò)力檢測。
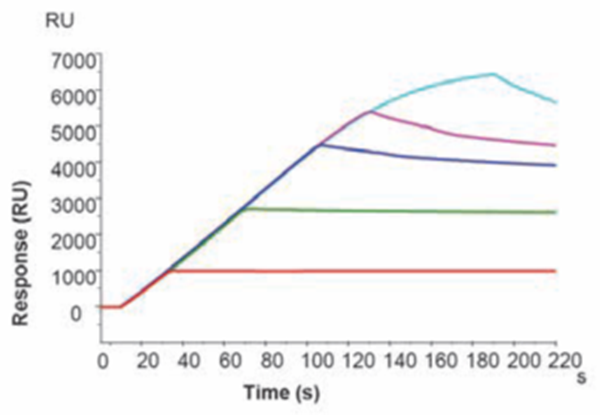
1. 在(zài)NTA芯片上(shàng),不(bù)同捕獲量水平下基線的(de)穩定情況[1]。
3氨基偶聯蛋白配體是(shì)選擇CM5芯片還是(shì)CM7芯片?
CM5與CM7芯片表面均爲(wéi / wèi)羧甲基化修飾的(de)葡聚糖基質,兩者最主要(yào / yāo)的(de)區别是(shì)CM7芯片的(de)羧基含量顯著高于(yú)CM5芯片,因此可以(yǐ)實現更高的(de)偶聯量。圖2比較了(le/liǎo)三對蛋白與小分子(zǐ)的(de)互作在(zài)CM5和(hé / huò)CM7芯片上(shàng)的(de)結果差異,可以(yǐ)看到(dào)同一(yī / yì /yí)組互作實驗,在(zài)CM7芯片上(shàng)可以(yǐ)達到(dào)的(de)偶聯量和(hé / huò)分析物響應值爲(wéi / wèi)CM5芯片的(de)3倍以(yǐ)上(shàng) [2] 。
2. 三組蛋白與小分子(zǐ)互作在(zài)CM5和(hé / huò)CM7芯片上(shàng)的(de)偶聯量與分析物響應值比較[2]。
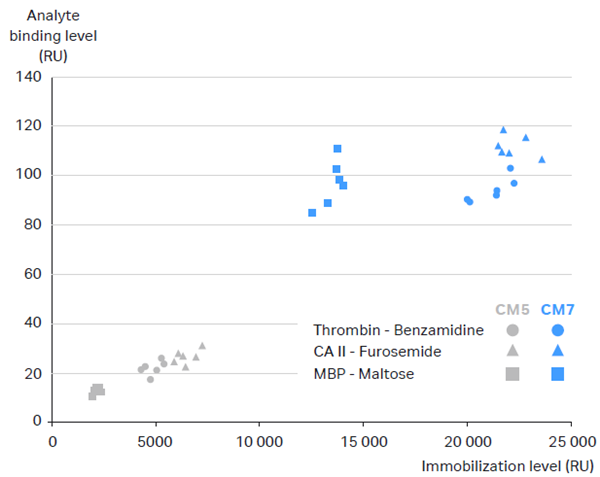
如上(shàng)所述,CM5芯片的(de)最高偶聯量在(zài)10000 – 15000 RU左右,如果按照固定量計算公式得到(dào)的(de)理論偶聯量遠超這(zhè)個(gè)範圍,則可以(yǐ)考慮使用CM7芯片。簡單來(lái)說(shuō),當蛋白與小分子(zǐ)的(de)分子(zǐ)量比值大(dà)于(yú)100時(shí),就(jiù)建議考慮換用CM7芯片。
二、樣品準備的(de)相關問題
在(zài)确定了(le/liǎo)配體的(de)固定策略,并選定了(le/liǎo)相應的(de)芯片之(zhī)後,就(jiù)可以(yǐ)開始下一(yī / yì /yí)步的(de)實驗了(le/liǎo)。進入試劑、樣品的(de)準備階段,又會遇到(dào)哪些問題呢?我們接着往下看。
如何選擇運行緩沖液?
目前Cytiva供應的(de)用于(yú)Biacore實驗的(de)運行緩沖液主要(yào / yāo)有兩大(dà)類,分别是(shì)基于(yú)HEPES緩沖體系的(de)HBS系列緩沖液與基于(yú)磷酸鹽緩沖體系的(de)PBS系列緩沖液。
在(zài)選擇運行緩沖液時(shí),并沒有明确的(de)規定必須使用何種緩沖液,應該根據分子(zǐ)互作的(de)自身性質選擇合适的(de)緩沖液。一(yī / yì /yí)般來(lái)說(shuō),有以(yǐ)下經驗可供參考:當分析物是(shì)小分子(zǐ)的(de)情況下可以(yǐ)首先嘗試PBS 或者PBS-P+緩沖液;而(ér)分析物爲(wéi / wèi)蛋白時(shí)可以(yǐ)首先嘗試HBS或者HBS-EP+緩沖液。
在(zài)一(yī / yì /yí)些情況下,小分子(zǐ)的(de)溶解需要(yào / yāo)一(yī / yì /yí)定濃度的(de)有機溶劑助溶,例如5% DMSO等,而(ér)這(zhè)些有機溶劑在(zài)不(bù)同樣品之(zhī)間的(de)濃度差異會幹擾響應值信号,因此需要(yào / yāo)對這(zhè)部分由運行緩沖液造成的(de)信号進行校正——溶劑校正。而(ér)有機溶劑自動校正的(de)功能,也(yě)是(shì)Biacore的(de)絕活兒之(zhī)一(yī / yì /yí),充分保證了(le/liǎo)最終實驗結果真實可信。關于(yú)溶劑校正的(de)相關問題将在(zài)下篇中進行讨論。
需要(yào / yāo)準備多少的(de)蛋白用來(lái)偶聯?
實驗準備的(de)配體蛋白量,至少要(yào / yāo)足夠其達到(dào)所需的(de)偶聯量。下表展示了(le/liǎo)要(yào / yāo)達到(dào)不(bù)同的(de)偶聯水平時(shí)所需的(de)配體濃度以(yǐ)及相應的(de)配體偶聯時(shí)間(流速爲(wéi / wèi)10 μL/min),可供參考[3]。需要(yào / yāo)注意的(de)是(shì),表中列出(chū)的(de)“配體工作濃度”是(shì)用偶聯緩沖液醋酸鈉稀釋配體蛋白樣品後的(de)濃度。爲(wéi / wèi)了(le/liǎo)讓稀釋後的(de)蛋白樣品能夠充分富集在(zài)芯片表面,醋酸鈉的(de)稀釋倍數一(yī / yì /yí)般要(yào / yāo)在(zài)20倍以(yǐ)上(shàng);如果稀釋倍數不(bù)夠,将影響配體蛋白偶聯效率。因此,準備配體蛋白母液時(shí)最好在(zài)工作濃度的(de)20倍以(yǐ)上(shàng)。
表1. 偶聯量與配體工作濃度參考表[3]。
對于(yú)一(yī / yì /yí)個(gè)未知的(de)實驗,摸索合适的(de)偶聯量等過程是(shì)必不(bù)可少的(de),因此對于(yú)蛋白配體的(de)用量也(yě)不(bù)應僅限于(yú)夠一(yī / yì /yí)次偶聯實驗使用。一(yī / yì /yí)般的(de)建議是(shì),配體蛋白的(de)準備量在(zài)1 mg/mL濃度、50 μL以(yǐ)上(shàng)。但即便如此,老師們也(yě)能清晰的(de)算出(chū)來(lái)Biacore對于(yú)蛋白的(de)用量非常低,遠遠優于(yú)您其他(tā)的(de)互作檢測手段。
小分子(zǐ)分析物的(de)濃度範圍如何确定?
不(bù)管在(zài)動力學(Kinetics)分析還是(shì)在(zài)親和(hé / huò)力(Affinity)分析中,分析物濃度範圍的(de)确定均與結合反應的(de)解離平衡常數(KD)有關。一(yī / yì /yí)般設置的(de)分析物濃度梯度範圍如果能夠覆蓋KD值,将會達到(dào)較準确的(de)拟合結果。在(zài)動力學分析中,一(yī / yì /yí)個(gè)理想的(de)分析物濃度範圍可以(yǐ)從10 × KD作爲(wéi / wèi)最高濃度進行梯度稀釋;在(zài)親和(hé / huò)力分析中,理想的(de)分析物濃度範圍可以(yǐ)選擇從2 × KD的(de)濃度作爲(wéi / wèi)最高濃度進行梯度稀釋[4]。對于(yú)蛋白與小分子(zǐ)的(de)互作,大(dà)多數情況下是(shì)“快結合快解離”的(de)模式,适用于(yú)親和(hé / huò)力分析的(de)模型(關于(yú)數據分析中模型選擇的(de)問題,将會在(zài)下篇中進行讨論)。蛋白與小分子(zǐ)結合反應的(de)KD值,基本都在(zài)μM級别,因此可以(yǐ)将小分子(zǐ)最高濃度設爲(wéi / wèi)1000 μM,按照3倍甚至5倍的(de)稀釋比例來(lái)配制濃度梯度(拉大(dà)範圍)。進行這(zhè)樣的(de)初步實驗後,基本可以(yǐ)确定反應KD值的(de)大(dà)緻範圍,後續可以(yǐ)調整濃度範圍、減小稀釋比例再進行進一(yī / yì /yí)步實驗。當然,小分子(zǐ)能夠達到(dào)的(de)最高濃度還受到(dào)溶解度等因素的(de)影響。
以(yǐ)上(shàng)是(shì)針對Biacore檢測蛋白與小分子(zǐ)互作的(de)實驗方案設計以(yǐ)及樣品準備方面的(de)常見問題分享。良好的(de)開端是(shì)成功的(de)一(yī / yì /yí)半,合理的(de)活性配體偶聯量、分析物濃度範圍以(yǐ)及運行緩沖液選擇,将幫助我們得到(dào)更理想的(de)實驗結果。在(zài)下篇中我們将繼續分享關于(yú)實驗進行以(yǐ)及數據分析方面的(de)常見問題,敬請期待!
文章來(lái)源:https://mp.weixin.qq.com/s/sG_kZkA5Kcdory0KPagPgw
